 El desarrollo del metanefros o riñón definitivo comienza en la quinta semana de la vida,.
El desarrollo del metanefros o riñón definitivo comienza en la quinta semana de la vida,.Aproximadamente el 20% de las nefronas se han formado a los 3 meses de gestación y un 30% a los 5 meses. Al término de la gestación, cada riñón contiene entre 85.0000 y 100.0000 nefronas.
La nefrogénesis se detiene generalmente antes de la completa maduración fetal, y un niño de bajo peso al nacimiento presenta un grado de nefrogénesis más acorde con la edad gestacional que con la talla.
La nefrogénesis continúa por tiempo variable durante el período postnatal en los prematuros, pero puede acabar antes de los que lo hubiera hecho en un feto intraútero. El crecimiento renal durante la lactancia y primera infancia depende de la hipertrofia de las unidades ya existentes, y generalmente el tamaño renal se corresponde bien con la edad y los parámetros normales de crecimiento somático. Sin embargo, en pacientes con una enfermedad renal intrínseca, anomalías cerebrales y algunas formas de enfermedades cardíacas congénitas, el tamaño renal puede ser considerablemente menor de lo esperado.
En el período postnatal la longitud y el tamaño tubular aumentan, haciéndose la longitud más homogénea
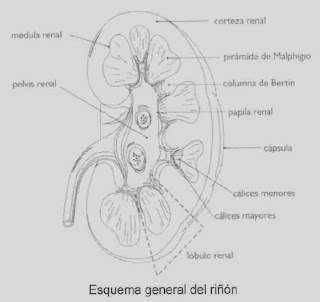
ANATOMÍA GENERAL DEL RIÑÓN
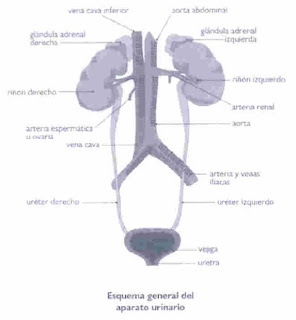
 Constituido por dos riñones, dos uréteres, la vejiga y la uretra.
Constituido por dos riñones, dos uréteres, la vejiga y la uretra.Riñones:
Son dos órganos macizos, uno derecho y otro izquierdo, situados en la región lumbar, uno a cada lado de la columna vertebral y algo por delante de ésta.
Tiene forma de habichuela y tiene dos bordes, uno externo y otro interno, en el que se localiza una hendidura central a la que se le denomina hilio renal. A través de este penetran en el riñón la arteria y los nervios y salen la vena renal y el uréter.
El riñón derecho se encuentra ligeramente más bajo que el riñón izquierdo debido a que es desplazado por el hígado.
La corteza renal es la porción más externa del riñón, de aspecto uniforme, aproximadamente de 1 cm de espesor y rodea la médula.
La médula renal es la porción más interna del riñón, con aspecto estriado y formada por pirámides cónicas llamadas pirámides de Malphigio. El número de estas oscila entre 8 y 18 en cada riñón. La base de cada pirámide se orienta hacia el exterior y el vértice hacia el hilio renal. En el vértice de la misma se localiza la papila renal.
La zona de la corteza renal situada entre cada dos pirámides se denomina columna de Bertín.
El corpúsculo renal está constituido por el Glomérulo y la Cápsula de Bowman. El glomérulo se constituye a su vez por una tupida red de capilares sanguíneos envueltos por la cápsula de Bowman. En el interior de esta cápsula entra una arteriola llamada aferente y sale otra llamada eferente.
La cápsula de Bowman es una membrana de doble hoja, que se invagina sobre sí misma para alojar al glomérulo, creando en su interior un espacio, el espacio de Bowman, donde se recoge la orina filtrada por el glomérulo.
El Túbulo Contorneado Proximal es la continuación del corpúsculo renal y presenta dos zonas, una situada en la corteza renal y otra en la zona medular, siendo esta última mucho más recta que la primera. La pared del túbulo contorneado proximal está constituida por una capa de células epiteliales apoyadas sobre una membrana basal.
Las células tubulares proximales se encargan del transporte activo del 80% del sodio que pasa del líquido filtrado a la sangre de los capilares.
EL asa de Henle tiene forma de U formada por una porción descendente y delgada y una porción ascendente que en su primera parte es delgada pasando a ser gruesa en su trayecto.
EL Túbulo Contorneado Distal es la continuación del asa de Henle
El Túbulo Colector es un tubo recto. Se reúne entre sí para desaguar en los cálices de la pelvis renal.
La superficie renal puede ser suave o mostrar surcos muy finos, restos de la lobulación fetal. Una sección sagital muestra que la corteza, con un grosor de unos pocos milímetros, se delimita claramente de la médula, en la que hay alrededor de diez elementos cónicos: las pirámides renales. Separando estas entre sí hay lengüetas de sustancia cortical. El vértice de cada pirámide medular es una papila renal, que vierte orina al cáliz menor. Algunos de éstos, drenan a los cálices mayores, que se continúan con la pelvis renal.
La unidad funcional del riñón, la nefrona, cyua función básica es limpiar el plasma sanguineo de sustancias indeseables a su paso por el riñón y retener las sustancias que requiere el cuerpo.
Cada glomérulo se compone de una red de capilares que se ramifican y se anastomosan encerrados en la cápsula de Bowman. Desde la luz capilar al espacio urinario pueden distinguirse tres capas en la membrana basal: lámina rara interna, lámina densa, lámina rara externa. En la parte externa de la pared capilar están las células epiteliales viscerales o podocitos, que se hallan sujetos a la parte exterior de la lámina rara externa mediante proyecciones citoplásmicas, los procesos podálicos; el espacio entre ellos es la hendidura epitelial. Un delicado diafragma establece la conexión entre dichos procesos. El mesangio está compuesto de matriz, un material parecido a la membrana basal, y células. Generalmente hay dos o tres células por cada área mesangial y frecuentemente una o dos células endoteliales en una sección transversal de un asa capilar. Al menos dos células epiteliales envían prolongaciones interdigitadas a una simple asa capilar. La pared del capilar glomerular es una estructura altamente aniónica a causa de sus glucoproteínas ácidas.
La cápsula de Bowman es una membrana en la que permanece el epitelio parietal. El espacio de Bowman, entre el ovillo glomerular y el epitelio parietal, se continua con la abertura del túbulo proximal, que se distingue generalmente por células con abundantes microvellosidades. Debajo de la unión corticomedular, la porción descendente del túbulo proximal se estrecha y el epitelio cúbico cambia a uno de tipo escamoso. Esto delimita la transición del túbulo proximal al asa de Henle. Asas de Henle de glomérulos superficiales y de la zona media de la corteza penetran en la médula con diferente grado de profundidad. Dependiendo de que las asas pertenezcan a una neurona superficial o yuxtamedular, los tipos de células pueden variar a lo largo del asa y las células pueden mostrar interdigitaciones simples o complejas o estar unidas fuertemente, mostrando varios grados de profundidad.
Uréteres
Son dos largos tubos, uno izquierdo y otro derecho, que comunican con su extremo superior con la pelvis renal y su extremo inferior con la vejiga urinaria. Su longitud aproximada es de 30cm
Su pared está formada por tres capas: una mucosa, que tapiza la luz del tubo, una capa de músculo liso y una capa externa o adventicia.
Vejiga
Actúa como reservorio de orina entre cada dos micciones. Es una especie de saco membranoso situada detrás de la sínfisis del pubis y con forma de pera. Presenta una base ancha de forma triangular, el trígono de lietaud, en cuyos vértices superiores desembocan los uréteres. En el vértice inferior tiene su comienzo la uretra.
Uretra
En la mujer es muy corta, unos 4 cm, mientras que en el varón mide unos 20 cm aproximadamente. Representa la parte final de las vías urinarias.
En el varón hay que distinguir tres segmentos:
Uretra prostática: en ella desemboca la próstata y los dos conductos deferentes
Uretra membranosa: presenta un engrosamiento de fibras musculares que corresponden al esfínter externo
Uretra cavernosa: termina en el meato urinario
El túbulo distal incluye la rama ascendente gruesa de Henle, la porción intermedia y la porción distal contorneada. En la rama ascendente gruesa de Henle las células se hacen progresivamente cúbicas. Este segmento del túbulo pasa a través de la médula externa y asciende a la corteza para contactar con su propio glomérulo, en el que las células tubulares están estrechamente unidas y presentan núcleos oscuros. Esta delimita la transición a la porción contorneada distal, en la que las células son altas y cuboidales y presentan numerosas microvellosidades cortas. Las porciones contorneadas cortas de muchas nefronas drenan a los túbulos colectores, que tienen dos tipos de células: células claras predominando a lo largo del túbulo colector, mientras que las células oscuras o intercaladas disminuyen en número desde la corteza a la médula. En la corteza el intersticio es fino y se compone de sustancia basal, material fibrilar y unas pocas células que parecen fibroblastos. En la médula interna el intersticio tiene más material fibrilar, más sustancia basal y un gran número de células intersticiales que contienen gotitas de grasa, las cuales parecen ser la fuente de prostaglandinas renales.
Cada arteria renal se divide en cinco segmentos que forman arterias interlobares. Al nivel de la unión corticomedular, las arterias interlobares se arquean para formar las arterias arcuatas, de las que se originan arterias interlobulares casi exactamente en los ángulos. De las arterias interlobulares en la corteza se originan arteriolas aferentes que forman ovillos glomerulares. Una arteriola eferente deja el glomérulo para unirse a una red de capilares que riegan las neuronas cortas (en la corteza) y las neuronas largas (en la médula). La red capilar peritubular desciende en manojo de vasos de pared fina (vasa recta), forma asas en horquilla a varios niveles en la médula y vuelve a la corteza para drenar a las venas interlobulares. Estas drenan a las venas arcuatas y luego a las interlobares, que dan lugar ala vena renal. Finos vasos linfáticos drenan el intersticio y la cápsula renal y pasan a anchos linfáticos que acompañan a los vasos venosos que dejan el riñón en el hilio. El aparato yuxtaglomerular en el hilio del glomérulo se compone de tres partes: células lacis, mácula densa y células epiteliales granulares, que se encuentran en las partes terminales de las arteriolas aferentes y eferentes, en las que reemplazan a las células de músculo liso. Los nervios adrenérgicos y colinérgicos siguen la distribución de los vasos arteriales e inervan a éstos en la corteza, en la médula externa y en el aparato yuxtaglomerular. No se han demostrado terminaciones nerviosas en los glomérulos o en los túbulos, así como tampoco en la región de la mácula densa.
VASCULARIZACIÓN DEL RIÑÓN
La arteria renal, que es una rama de la aorta abdominal, penetra en el riñón a través del hilio, ramificándose internamente de manera que el riñón sea uno de los órganos mejor vascularizado.
La arteria renal se ramifica formando pequeñas arterias interlobulares que van a la zona cortical para formar las arterias arqueadas que se sitúan alrededor de la base de las pirámides. De estas arterias arqueadas nacen las arteriolas aferentes que llegan a la cápsula de Bowman para dividirse en su interior en una tupida red de capilares, los capilares glomerulares.
Los capilares glomerulares vuelven a fusionarse entre sí para dar lugar a una arteriola eferente que abandona la cápsula de Bowman y, a su vez, desaguan en las venas interlobulares y estas a su vez en la vena renal que abandona el riñón por el hilio renal. La vena renal desemboca en la vena cava inferior.
El flujo de sangre que llega al riñón es muy elevado, 1200ml/min, lo que representa la quinta parte de sangre que bombea el corazón en un minuto.
La sangre es sometida en el riñón a un proceso de depuración donde son eliminados todos aquellos metabolitos de deshecho y sustancias que se encuentran en exceso, para mantener así el equilibrio homeostático.
Funciones del riñón
La función principal del riñón es su contribución al mantenimiento de la composición normal de la sangre. Y esto lo realiza de la siguiente manera:
La excreción de agua.
La excreción de los productos terminales del metabolismo de las proteínas
La excreción de electrolitos
La excreción de medicamentos, toxinas y cuerpos químicos que pudieran ocasionar daño.
Contribuye a la regulación del ph de la sangre.
Formación de la orina
Los riñones emplean tres procesos distintos en la producción de la orina:
Filtración: realizado a través de los glomérulos
Secreción: es un proceso activo, que ocurre principalmente en los túbulos contorneados, mediante el cual las células de revestimiento epitelial cúbico seleccionan sustancias anormales o que se encuentran en exceso y las vierten a la luz de los túbulos.
Absorción: parte del agua y de las sales son reabsorbidas y devueltas a la sangre circulante por las células renales, especialmente las del asa de Henle.
Composición de la orina
Agua (en cantidad variable), urea, ácido úrico, nitrógeno total, amoniaco, cloruros, fosfatos, creatinina, 17-cetosteroides.
Densidad específica: 1,003-1,025
Reacción: ligeramente ácida (ph entre 6 y 6,6)
La micción
La micción o vaciado de la vejiga es un acto reflejo regulado por la médula espinal y los nervios simpáticos y parasimpáticos.
El estímulo simpático hace que se relaje la vejiga y se contraiga el esfínter. Se cierran los orificios uretrales, se contrae el esfínter interno.
La estimulación parasimpática relaja el esfínter interno, estimula el músculo detrusor y hace que se vacíe la vejiga.
Cuando se llena la vejiga, la presión interior que se va formando estimula los receptores de tensión y provoca contracciones reflejas del músculo detrusor y surge la necesidad de la micción.
Los lactantes que no han desarrollado aún control voluntario sobre el esfínter uretral externo, orinan de manera automática cada vez que se les llena la vejiga
La función renal en el recién nacido
En el recién nacido, los riñones están completamente desarrollados y tiene un gran número de nefronas que funcionan deficientemente. Esto es debido al tamaño de los poros glomerulares y a la inmadurez del sistema enzimático.
Además el recién nacido es incapaz de concentrar la orina, debido en parte ala brevedad del asa de Henle.
Los fármacos pueden también ocasionar problemas ya que algunos son de eliminación renal fundamentalmente y pueden provocar toxicidad (como el fenobarbital) o daño glomerular (como los antibióticos).
A pesar de la deficiencia funcional de los riñones del recién nacido, un lactante sano puede mantener su medio interno aunque reciba algunos alimentos que son fisiológicamente inadecuados.
Como no todos los glomérulos funcionan en el momento de nacer, la velocidad de filtración glomerular es menor que la de los lactantes mayores; el pleno funcionamiento se alcanza hacia la sexta semana de vida.
Órganos genitales masculinos
El escroto
Es una bolsa que contiene los testículos, el epidídimo y el origen de los conductos deferentes.
Los testículos
Embriológicamente los testículos se originan a nivel de la 11ª y la 12ª, vértebras torácicas; en su migración hacia el escroto arrastran con ellos a la arteria testicular.
Son estructuras pares que constituyen el contenido principal del saco escrotal, y están suspendidas del cordón espermático.
Histológicamente los testículos varían con la edad; se pueden diferenciar tres etapas concretas: infantil, adulta y senil. Se organizan en lóbulos independientes, cada uno de los cuales contiene de uno a tres tubos seminíferos, enrollados, que se encargan de la espermatogénesis.
El epidídimo
Es un sistema recolector que está estrechamente unido al cuerpo de los testículos. Es más ancho en su extremo superior ( globo mayor ) y se estrecha hacia la parte de la cola ( globo menor), que continúa con el conducto deferente.
Los conductos deferentes
Son unos tubos que nacen del globo menor de ambos epidídimos y ascienden por el escroto y el canal inguinal. Histológicamente, el conducto posee una gruesa capa de músculo liso.
El pene
Es el órgano masculino de la copulación y de la micción; está constituido por la raíz, el cuerpo y el extremo o glande. La raíz se une a las ramas descendentes del pubis mediante la crura, que son los extremos de los cuerpos cavernosos. El cuerpo está formado por dos estructuras cilíndricas paralelas, los cuerpos cavernosos, debajo de los cuales se encuentra el cuerpo esponjoso, por el que pasa la uretra. El glande está cubierto por mucosa y envuelto por el prepucio.
Órganos genitales femeninos
Los ovarios
Son las gónadas femeninas, encargadas de la formación de los óvulos. Hay uno en cada lado, situados en una ligera depresión de la pared lateral de la pelvis.
En los ovarios fetales e infantiles se encuentran grandes cantidades de folículos primarios de Graaf. Algunos de estos folículos maduran bajo la influencia de la hormona foliculoestimulante desde la pubertad hasta la menopausia.
Las trompas de Falopio
Son dos delgados conductos, situados uno a cada lado del útero, que poseen una abertura en forma de trompeta y un reborde con flecos (extremo fimbriado) y desembocan medialmente en la parte superior del útero. El extremo fimbriado se encuentra muy próximo a los ovarios; los óvulos penetran en la trompa de Falopio y avanzan a lo largo del conducto con ayuda de los cilios de la mucosa y de los movimientos peristálticos de sus paredes.
El útero
Es un órgano muscular hueco en el que anida el óvulo fecundado y donde se nutren el embrión y el feto durante su desarrollo. Tiene forma de pera y consta de cuerpo, fondo, istmo y cuello. Su cavidad se abre a la vagina por debajo, y a las trompas de Falopio por arriba a ambos lados. Está sustentado por una serie de ligamentos.
La vagina
Es un canal curvo que va desde el útero y se dirige hacia arriba y hacia delante hasta los genitales externos. La abertura vaginal está cerrada parcialmente por una lámina de mucosa denominada himen
Los órganos genitales externos
En conjunto se denomina vulva a los genitales externos; comprenden el monte pubiano, los labios menores, los labios mayores, el vestíbulo y el clítoris. Este último se encuentra entre los extremos anteriores a los labios menores. Equivale al pene masculino y está formado por tejidos similares.http://www.eccpn.aibarra.org/temario/seccion9/capitulo139/capitulo139.htm







